琼脂糖凝胶电泳实验常见问题分析
发布时间:
2024-01-15 15:07
琼脂糖凝胶电泳实验常见问题分析
琼脂糖凝胶电泳已经成为一种分析鉴定重组DNA分子及蛋白质与核酸相互作用的重要实验手段,也是分子生物学研究的重要方法,常用于DNA分型、鉴定DNA、RNA分子混合物、DNA核苷酸序列分析等技术,以琼脂凝胶作为支持物,利用 DNA 分子在电场中的电荷效应和分子筛效应,达到分离混合物的目的。
现在我们一起了解一下琼脂糖凝胶电泳的工作原理和实验中常见的问题和解决方法。
- 什么是电泳?
电泳是一种利用电流根据DNA、RNA或蛋白质的物理特性(如大小和电荷)来分离它们的技术。
- 什么是琼脂糖?
琼脂糖是一种线性多糖聚合物,从红色海藻产物琼脂中提取而来。将琼脂糖粉末加热到熔点后冷切凝固便会形成良好的电泳介质,其密度由琼脂糖的浓度决定。
- 什么是琼脂糖凝胶电泳?
琼脂糖凝胶电泳是一种电泳形式,用于根据核酸(DNA或RNA)片段的大小进行分离。当施加电流时,带负电的DNA/RNA通过琼脂糖凝胶的孔隙向凝胶带正电的一端迁移,较小的片段迁移较快。由此产生的条带可以用紫外线(UV)光来观察。
- 琼脂糖凝胶电泳实验技巧和注意事项
- 琼脂糖凝胶溶液配制时总液体量不宜超过锥型瓶50%容量。否则会溢出。
- 加热过程中要不时摇动,使附于瓶壁上的琼脂糖颗粒进入溶液。加热时应盖上封口膜,以减少水份蒸发。
- 注意不要损伤梳底部的凝胶。一个是在拔梳子的时候,一个是在加样时。
- 凝胶浓度越低(非常脆弱且难以处理),分辨的片段越大;凝胶浓度越高(很脆且可能凝固不均匀),分辨的片段越小。所以在制胶的时候要特别注意。
- 琼脂糖凝胶电泳常见问题与异常分析
Q1:为什么marker条带非常模糊,无法辨别具体条带?
A1:出现上述情况,可能有以下几个原因:
1. marker条带出现了降解。请确保在使用过程中避免核酸酶污染;
2. 电泳缓冲液陈旧。电泳缓冲液多次使用后,离子浓度降低,pH值上升,缓冲能力减弱,从而影响电泳效果,建议经常更换电泳缓冲液;
3. 电泳条件不合适。电泳时电压应不超过20V/cm,温度应低于30℃;
4. marker上样量过多。请根据说明书选用合适上样量;
5. 凝胶质量不好。建议使用质量较好的琼脂糖;此外,凝胶凝固不均匀也会导致条带模糊。
Q2:为什么marker条带出现不规则的条带(如哑铃状等)?
A2:出现上述情况,多与以下几个原因有关:
1. 电泳缓冲液陈旧。老化的电泳缓冲液离子浓度降低,pH值上升,缓冲能力减弱,从而影响电泳效果,建议经常更换电泳缓冲液;
2. 电泳条件不合适。电泳时电压应不超过20V/cm,电压太高可能也会导致marker条带出现不规则现象。此外,凝胶质量差以及凝胶冷却时凝固不均匀也会导致该现象出现。
Q3:为什么marker条带非常弱或者根本没有条带?
A3:出现上述情况可能是:
1. marker上样量较低,可适当增加上样量;
2. 凝胶质量较差或凝胶凝固不均匀也会导致电泳条带弱或根本没有条带;
3. 电泳时间过长导致marker条带跑出凝胶,可缩短电泳时间,降低电压,增加凝胶浓度。
Q4:为什么marker缺带?
A4:对于含有较小片段的marker,如果出现缺带现象,可能是因为:
1. 小条带跑出凝胶或分子量大小非常相近的条带不易辨认所致,可适当缩短电泳时间,降低电压,同时增加凝胶浓度;
2. 凝胶中染料含量过低,导致大片段结合染料量太少或没有,在蓝光仪下亮度太低,可适当增加染料用量。
Q5:加样孔出现荧光
1. 原因分析:大片段DNA的滞留;
2. 解决方法:样品出现溢出,应该通过降低模板量或浓度来处理;

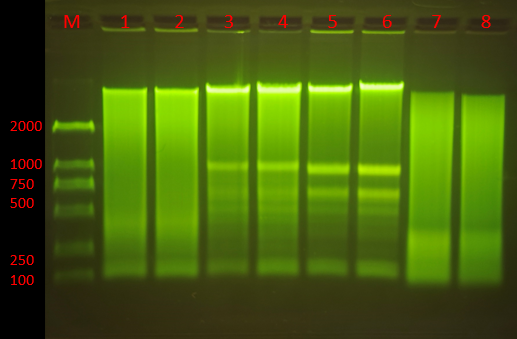
Q6:条带模糊或弥散
1. 原因分析:
(1)DNA发生降解;
(2)电泳缓冲液陈旧;
(3)电泳条件不合适;
(4)核酸样品纯度差,含有DNA结合蛋白或高浓度的盐分;
(5)染色时间过长或拍照前放置过久,DNA条带弥散;
(6)PCR非特异性的扩增;
(7)加样时操作不当,样品飘出样孔;
2. 解决方法:
(1)更换缓冲液;
(2)根据凝胶大小和电泳缓冲液类型,使用适当的电压进行电泳;
(4)电泳结束后及时观察、拍照;
(5)DNA Maker进行对照,校正是否为电泳体系的问题;
(6)使用特异性较高的引物;
(7)降低电泳时的上样量,并小心谨慎操作实验;
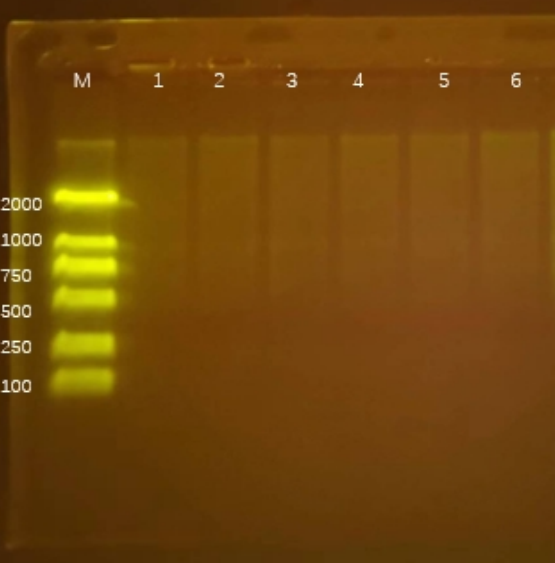
Q7:无条带或者弱条带
- 原因分析:
(1)DNA的上样量不够;
(2)DNA发生降解;
2. 解决方法:
(1)增加上样量;
(2)防止DNA降解,如:避免反复冻融样品、避免核酸酶的污染。
Q8:DNA Marker降解
- 原因分析:
- 核酸酶污染;
- 保存不当;
- 解决方法:
- 每次吸取时更换灭菌枪头,勿将电泳缓冲液带入管中、用后密闭4°C保存;
(2)4°C 或-20°C保存,避免多次反复冻融、不可加热;
Q9:DNA Marker无正确分离
- 原因分析:
- 琼脂糖质量差;
- 电泳缓冲液多次使用后失效;
- 解决方法:
- 使用质量可靠的琼脂糖制胶;
- 更换缓冲液;
Q10:条带缺失
- 原因分析:
- DNA条带分子量过大;
- 分子量接近的DNA条带没有分开;
- 电泳缓冲液使用不当;
- 电泳时间过长或电压过高,DNA走出凝胶
- 电极插反,DNA走出凝胶
- 解决方法:
(1)使用脉冲凝胶电泳;
(2)选择适当的凝胶浓度进行电泳;
(3)SD和TBE缓冲液适于分析较小分子量的核酸片段,大片段分子不能完全分离;TAE缓冲液不适于分离很小的核酸片段;
(4)缩短电泳时间,调整电压;
(5)正确连接电极方向;
Q11:条带大小不正确
- 原因分析:
- 核酸降解或形成聚合物;
(2)λ DNA酶切Marker的cos位点复性;
(3)相同分子量的核酸片段由于结构或序列的差异而有不同的迁移率;
(4)梳子变形,点样孔不在同一水平线上;
2. 解决方法:
(1)加热处理或重新制备样品;
(2)电泳前65°C加热5分钟,冰上冷却5分钟以后再上样;
(3)判断核酸分子是否有特殊结构,如缺口、超螺旋、二聚体等;富含AT碱基的DNA迁移率比同分子量富含GC碱基的核酸片段慢;
(4)使用完好的梳子制胶。
Q12:小片段扩散,条带模糊,粗
- 原因分析:
- 错误选择了低浓度凝胶,观察大片段用低浓度凝胶,观察小片段要用高浓度;
- 琼脂糖质量不好,质量不好的琼脂糖分离小片段容易扩散,即使是使用高浓度凝胶;
- 选择了不合适的电泳缓冲液 ;
- 解决方法:
- 比如观察100bp的小片段用2%凝胶跑电泳;
- 换用质量好的琼脂糖;
- SD和TBE缓冲液适于分析较小分子量的核酸片段,大片段分子不能完全分离;TAE缓冲液不适于分离很小的核酸片段。
Q13:条带偏移扭曲
- 原因分析:
- 琼脂糖凝胶配置出现问题;
- 凝胶未完全凝固;
- 凝胶在电泳槽中位置摆放偏移;
- 解决办法:
- 应准确配置琼脂糖凝胶,并充分进行凝固;
- 应固定好凝胶在电泳槽中的位置,避免电泳过程中出现偏移;
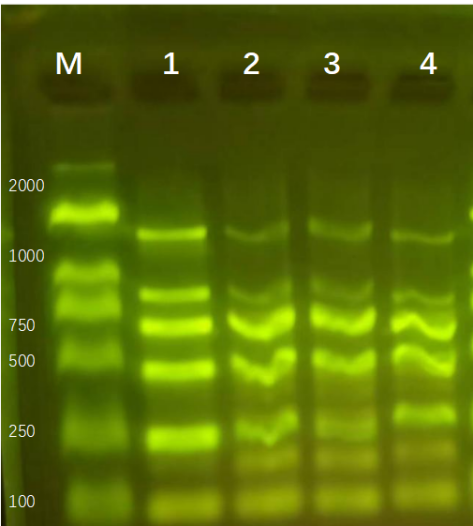
雷火竞技自主研发的磁珠法核酸提取试剂,可以提取高质量的核酸DNA/RNA,进行琼脂糖凝胶电泳,能够得到清晰、明亮、完整的条带,并且操作简单快速,整个流程基本分为(裂解结合、洗涤、干燥、洗脱),大多数10-30min内即可完成。可针对血液、血清/血浆、唾液、细菌、真菌、拭子、粪便、动植物组织、中草药、石蜡包埋组织、PCR产物、测序反应产物等样本,分离纯化高质量基因组DNA/RNA、cfDNA、ctDNA或病毒核酸。
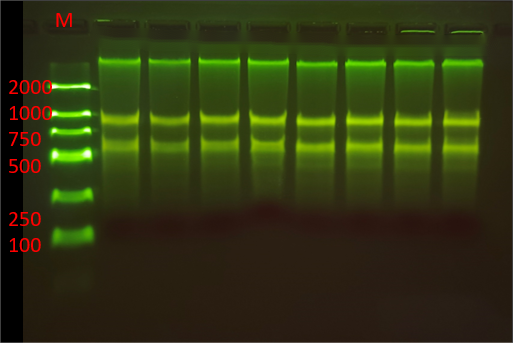
图 新鲜yan叶DNA/RNA提取电泳图
欢迎咨询、采购!
推荐新闻



